Un misil de precisión contra el cáncer
La quimioterapia y los tratamientos biológicos se unen La combinación de fármacos permite abordar tumores difíciles Las resistencias obligan a cambiar los protocolos
En los países ricos, más de la mitad de los cánceres se curan. Pero en el mundo las cifras no son tan buenas: se diagnostican 13 millones de casos al año, y mueren ocho millones, según datos de la Organización Mundial de la Salud. Esos nichos variantes resistentes a los fármacos son el objetivo principal del congreso de la Asociación Americana de Oncología Médica (ASCO en inglés) que se celebra en Chicago desde el 1 de junio y que concluirá el 5.
Porque la paradoja es que cuanto más se sabe de la enfermedad, más casos hay en el mundo. “Un 70% más que en los años treinta”, como dijo el presidente del congreso, Michael Link, el jueves en su primera comparecencia. La revolución de los tratamientos biológicos (llamados personalizados porque actúan según los genes de cada uno) ha dado un nuevo paso con uno de los productos presentados en las sesiones plenarias (las de más prestigio del congreso). Se trata de aunar un potente quimioterápico, el TDM1, con un anticuerpo monoclonal, el trastuzumab (el Herceptin de Roche, laboratorio que ha invitado a EL PAIS al congreso). Es solo un ejemplo para unos tumores muy específicos (los de mama HER2+), pero son la señal de hacia dónde va el futuro.
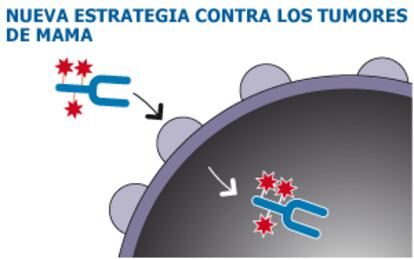
El estudio se ha llamado Emilia, “en honor de una heroína antigua”, como dijo Kimberley Blackwell, de la Universidad de Duke. El objetivo es utilizar la afinidad que el medicamento tiene por las células tumorales HER2 positivas (es el tipo del 20% de los cánceres de mama), y utilizarla como un caballo de Troya para hacerle llegar un potente agente quimioterápico, el denominado TDM1. Este producto es tan tóxico que no se puede suministrar libremente, pero así va guiado hasta donde tiene que actuar. En los casos más duros, los de tumor metastásico (cuando se ha extendido), se consigue una supervivencia a dos años en el 65,4% de las pacientes, frente al 47,5% con tratamiento de quimioterapia combinada. A los 36 meses, la diferencia se mantenía.
Un estudio usa un fármaco de caballo de Troya de un fuerte quimioterápico, tóxico si se administra directamente
“Es un misil de precisión”, ha dicho Joan Albanell, jefe del Servicio de Oncología Médica del Hospital del Mar de Barcelona, parte de un estudio en el que han participado un millar de pacientes de todo el mundo, de las que 35 estaban siendo tratadas en nueve hospitales españoles.
Javier Cortés, jefe del Grupo de Mama del hospital Vall d'Hebrón de Barcelona afirma que se está viviendo en este tipo de tumor “una auténtica revolución”. Junto al novedoso sistema de usar un fármaco para liberar otro dentro del tumor, sin dañar al resto, Cortés destaca otro trabajo, el Cleopatra, que consiste en combinar otro fármaco con el tratamiento en los casos de tumor metastásico. “La FDA [agencia estadounidense del medicamento] está a punto de aprobarlo”, afirma, porque prolonga en seis meses de media, de 12 a 18, el tiempo que las mujeres pueden hacer una vida normal. Es una muestra de que en cáncer, nada se desaprovecha. El medicamento añadido, de hecho, había fracasado como tratamiento si se da solo, y ahora dispone de una nueva oportunidad.
Las investigaciones tratan de prolongar aún más la supervivencia del paciente
Este actúa sobre otro receptor de la célula tumoral, el denominado HER3, ha explicado Mark Slimkowski, del grupo de investigación en oncología gRED. “El objetivo es superar la aparición de resistencia desarrollando nuevas terapias que puedan retrasar esa pérdida de sensibilidad al fármaco. En definitiva, se trata de prolongar aún más la supervivencia”, dice Albanell.
Otra línea en la que se está investigando es en facilitar la vía de administración. En vez de recibirlo por vía intravenosa, se trabaja para que la paciente pueda inyectárselos por vía subcutánea.
Toda esta especialización no quiere decir que no se busquen tratamientos generales, de amplio espectro. Y, en esa línea, la estimulación del propio sistema inmunitario del paciente para que ataque a sus células cancerosas es una de las favoritas. Y de las más complicadas.
El laboratorio BMS, por ejemplo, está trabajando en un nuevo fármaco, llamado PD-1 (PD de programmed death, muerte programada). Se trata de intentar que las células del sistema inmunitario que reconocen un tumor, las llamadas células T, no pierdan la capacidad de atacarlas. Porque han descubierto que en las células cancerígenas hay unos ligandos, los PD-L, que servirían para identificarlas. Pero como ha explicado Suzanne Louis Topalian, de la Universidad Johns Hopkins, estas crean una especie de escudo, y la acción de las células T se inactiva.
El ensayo, aún en fase I (la primera, prácticamente para medir toxicidad y poco más) ha sido “bien aceptado en general por los pacientes”, y tiene la ventaja de que es de amplio espectro: ha funcionado de alguna manera en pacientes con melanoma, cáncer de pulmón y riñón. “En la mitad de los casos ya habían recibido hasta tres tratamientos”, dijo Topalian, por lo que en su caso cualquier avance es una gran mejora. Claro que la idea de los investigadores es poder usarlo desde el primer diagnóstico.
Lo que prefiera el paciente
Es un estudio pequeño, pero su novedad le ha merecido el honor de ser uno de los cuatro seleccionados cada día por la organización del congreso de la Asociación Americana de Oncología Médica en Chicago. Como explica Bernard Escudier, jefe de Asistencia Clínica de los hospitales de París, en “los últimos cinco años han aparecido siete fármacos para el cáncer de riñón, y ninguno parece mejor que los otros”. ¿La solución? Que decidan los pacientes. Para ello se diseñó un ingenioso ensayo. A un grupo se le dio uno de ellos durante 10 semanas, y al otro, el rival. Pasado ese tiempo, se cambiaron los tratamientos. Ni los médicos ni los pacientes sabían qué estaba tomando cada uno. Y, al final, se les preguntó qué preferían. “De una manera muy sorprendente”, un 70% se decantó por uno de ellos. Y, contra a lo que los expertos esperaban, en todos los aspectos sobre los que se preguntó a los pacientes (calidad de vida, fatiga) elegían mayoritariamente el mismo.
El trabajo tiene un problema, como se puso de manifiesto durante su presentación. El ensayo estaba financiado por uno de los fabricantes, que fue el que obtuvo el mejor resultado, pero lo que importa es que gana espacio la idea de preguntar a los pacientes.
En la misma línea se presentó otro trabajo para ver por qué las personas con menos ingresos eran más reacias a participar en ensayos clínicos. Solo el 9% de los enfermos de cáncer se prestan a esta colaboración, fundamental para el avance de la ciencia. Y cuanto más amplia sea la representación, más extrapolables serán los resultados. Pero la falta de tiempo y de posibilidad para ir al trabajo, el precio de los desplazamientos y el miedo a tener que pagar parte del ensayo se demostraron determinantes.
La dificultad es que cada vez hay que añadir más tratamientos, y eso encarece el proceso. Para reducir el despilfarro, se buscan marcadores (moléculas que se puedan detectar mediante un análisis de sangre) para saber qué medicamento va a funcionar. También se potencian los análisis genéticos. Los grandes centros ya trabajan todos en tener unidades de análisis de este tipo. Genes como los BRCA1 y 2, marcadores como los HER2 y 3, el MLH1, SMH2... el cáncer se especializa. Y ello es bueno para los pacientes.
Tu suscripción se está usando en otro dispositivo
¿Quieres añadir otro usuario a tu suscripción?
Si continúas leyendo en este dispositivo, no se podrá leer en el otro.
FlechaTu suscripción se está usando en otro dispositivo y solo puedes acceder a EL PAÍS desde un dispositivo a la vez.
Si quieres compartir tu cuenta, cambia tu suscripción a la modalidad Premium, así podrás añadir otro usuario. Cada uno accederá con su propia cuenta de email, lo que os permitirá personalizar vuestra experiencia en EL PAÍS.
¿Tienes una suscripción de empresa? Accede aquí para contratar más cuentas.
En el caso de no saber quién está usando tu cuenta, te recomendamos cambiar tu contraseña aquí.
Si decides continuar compartiendo tu cuenta, este mensaje se mostrará en tu dispositivo y en el de la otra persona que está usando tu cuenta de forma indefinida, afectando a tu experiencia de lectura. Puedes consultar aquí los términos y condiciones de la suscripción digital.



















