El cáncer de pulmón sube al tren de la terapia personalizada
Los tratamientos individualizados despegan en estos tumores tras llegar con retraso En un 28% de los pacientes hay alteraciones genéticas tratables
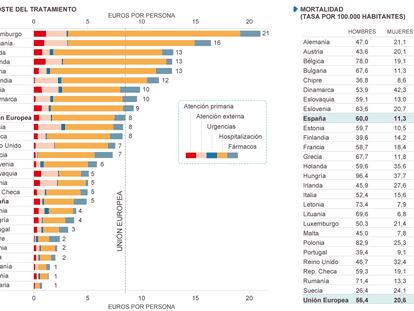
El cáncer de pulmón es de los más comunes y de los más letales. También ha sido de los últimos en beneficiarse de las terapias personalizadas, aquellas que se administran selectivamente en función de las características particulares (genéticas, moleculares) que presenta el tumor en cada paciente y que a lo largo de la última década han servido —de la mano de la quimioterapia— para mejorar la supervivencia y la calidad de vida de los enfermos.
Pero no todo son malas noticias en este tumor. “Aunque se haya tardado más que otras neoplasias, como las de mama, en el caso del pulmón, es el tratamiento que está accediendo más rápidamente a las terapias individualizadas”, destaca Bartomeu Massuti, secretario del Grupo Español de Cáncer de Pulmón (GECP). Esta entidad, que el próximo jueves y viernes celebra su décimo congreso en Barcelona, ha puesto el acento en estos tratamientos como “vía de futuro para tratar la enfermedad”.
El grupo de cáncer de pulmón apoya este argumento con los resultados de un estudio muy reciente, aún sin publicar, que el Consorcio Mutaciones en Cáncer de Pulmón —LCMC, en inglés, formado por 16 centros de investigación estadounidenses— presentó hace dos semanas en Sidney (Australia), en la Conferencia Mundial en Cáncer de Pulmón. El trabajo buscó entre 1.000 pacientes afectados de neoplasia de pulmón diez alteraciones genéticas —adquiridas, no heredadas— vinculadas con el tumor para las que existiera un medicamento. Y concluyó en que el 28% de los enfermos presentaban mutaciones genético-moleculares potencialmente tratables con fármacos que ya están en el mercado o se encuentran en las últimas fases de ensayos clínicos. Además, los pacientes con metástasis que se trataron con medicamentos dirigidos tuvieron una supervivencia mediana de tres años, uno más que el resto (comparado con quienes tenían alteraciones que no fueron tratadas de forma específica y con los que no presentaban características susceptibles de ser abordadas). “El trabajo arroja una importante prueba de concepto: si tienes alteraciones genéticas y las tratas, los pacientes resultan beneficiados”, añade Massuti.
El grueso de las alteraciones tratables conocidas hasta ahora son las mutaciones en el gen EGFR (presentes en un 15% de los pacientes caucásicos, más del 30% en asiáticos). Existen dos fármacos aprobados en España para combatir la proliferación celular derivada de esta alteración: el gefitinib y el erlotinib. Y otro más a la espera: el afatinib. Para el resto de mutaciones —algunas presentes en solo el 1% de enfermos— hay una decena de fármacos en las últimas etapas de desarrollo. Algunos son accesibles a través de atajos administrativos como el de la solicitud del uso de medicamento extranjero. Otros, solo están disponibles para los participantes de ensayos clínicos.
Al margen de estas limitaciones de acceso, los oncólogos destacan que es necesario adaptar las estructuras sanitarias a esta nueva etapa que se está abriendo paso. Es decir, capacitar y coordinar una red de laboratorios que analicen las muestras de los pacientes para determinar cuáles de ellos tienen tumores susceptibles de ser tratados con estas nuevas terapias. “La generalización de estas determinaciones, probablemente con una estructura en red, de acceso y cobertura nacional y con controles de calidad es clave para la selección de pacientes [y su tratamiento]”, apunta Massuti.
En España, en la mayoría de los centros se buscan, al menos, las dos principales mutaciones (la del EGFR y la del gen ALK, presente en entre el 5% y el 8% de pacientes), aunque depende de si los hospitales tienen laboratorios genéticos o si mantienen acuerdos para remitir las muestras a otros centros. “Lo ideal sería contar con una estructura centralizada, pública, que analizara las biopsias remitidas, que pemitiera la selección de pacientes y homogeneizara la accesibilidad a estos tratamientos”, insiste Massuti.
¿Tiene sentido plantear esta iniciativa en un escenario de recortes como el actual? El grupo español de cáncer de pulmón está convencido de ello. No solo por la mejora de expectativa de vida que ofrece o la eficiencia que supone administrar a cada paciente el fármaco que mejor resultado ofrece. “No tiene sentido que un hospital haga esta técnica cada 10 días con el coste en equipos o reactivos que supone; mi aspiración es que las autonomías centralizaran la actividad en uno o dos centros”, concluye Massuti.